ЭЛЕКТРИЧЕСКИЙ ТОК В ЖИДКОСТЯХ
Жидкости по степени электропроводности делятся на:
- диэлектрики (дистиллированная вода),
- проводники (электролиты),
- полупроводники (расплавленный селен).
Электролит
- это проводящая жидкость (растворы кислот , щелочей, солей и расплавленные соли).
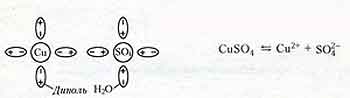
Электролитическая диссоциация (разъединение)
- при растворении в результате теплового движения происходят столкновения молекул растворителя и нейтральных молекул электролита.
Молекулы распадаются на положительные и отрицательные ионы.
Например, растворение медного купороса в воде.
Ион
- атом или молекула, потерявшая или присоединившая к себе один или несколько электронов;
- существуют положительные ( катионы ) и отрицательные ( анионы ) ионы.
Рекомбинация ионов
- Наряду с диссоциацией в электролите одновременно может происходить процесс восстановления ионов в нейтральные молекулы.
- Между процессами электролитической диссоциации и рекомбинации при неизменных условиях устанавливается динамическое равновесие.
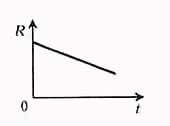
Зависимость сопротивления электролита от температуры
Температурная зависимость сопротивления электролита объясняется в основном
изменением удельного сопротивления.
где альфа - температурный коэффициент сопротивления.
Для электролитов всегда
Поэтому
Сопротивление электролита можно рассчитать по формуле:
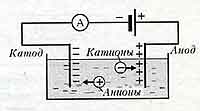
Явление электролиза
- сопровождает прохождение эл.тока через жидкость;
- это выделение на электродах веществ, входящих в электролиты;
Положительно заряженные анионы под действием электрического поля стремятся к отрицательному катоду, а отрицательно заряженные катионы - к положительному аноду.
На аноде отрицательные ионы отдают лишние электроны ( окислительная реакция )
На катоде положительные ионы получают недостающие электроны ( восстановительная реакция ).
Закон электролиза
1833г. - Фарадей
Закон электролиза определяет массу вещества, выделяемого на электроде при электролизе за время прохождения эл.тока .
k - электрохимический эквивалент вещества, численно равный массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл.
Зная массу выделившегося вещества, можно определить заряд электрона.
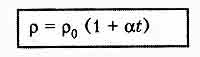
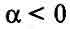
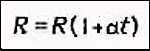
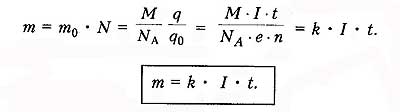
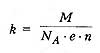

Очень хорошо получается!
ОтветитьУдалить